140
препаратов
.
Им
предшествуют
многолетние
(
в
среднем
около
10
лет
)
доклинические исследования
ЛС
:
лабораторные исследования
в
пробирках и
тестирование наживотных
.
Их
цель
–
научное
доказа
-
тельство
эффективности
и
безопасности
ЛС
.
БМИ
предполагает
разработку
дизайна
исследования
–
т
.
е
.
общего
плана
исследова
-
ния
,
описания
того
,
как
оно будет проводиться
.
Поясните
,
чем
обусловлена
необходимость
проведения
до
-
клинических испытаний
.
Сформулируйте цельКИ
лекарственных
средств
.
Используя
табл
. 8,
охарактеризуйте
стадии
(
фазы
),
которые
проходят
КИ
.
Какие
категории
субъектов
принимают
участие
в
каждойиз них
?
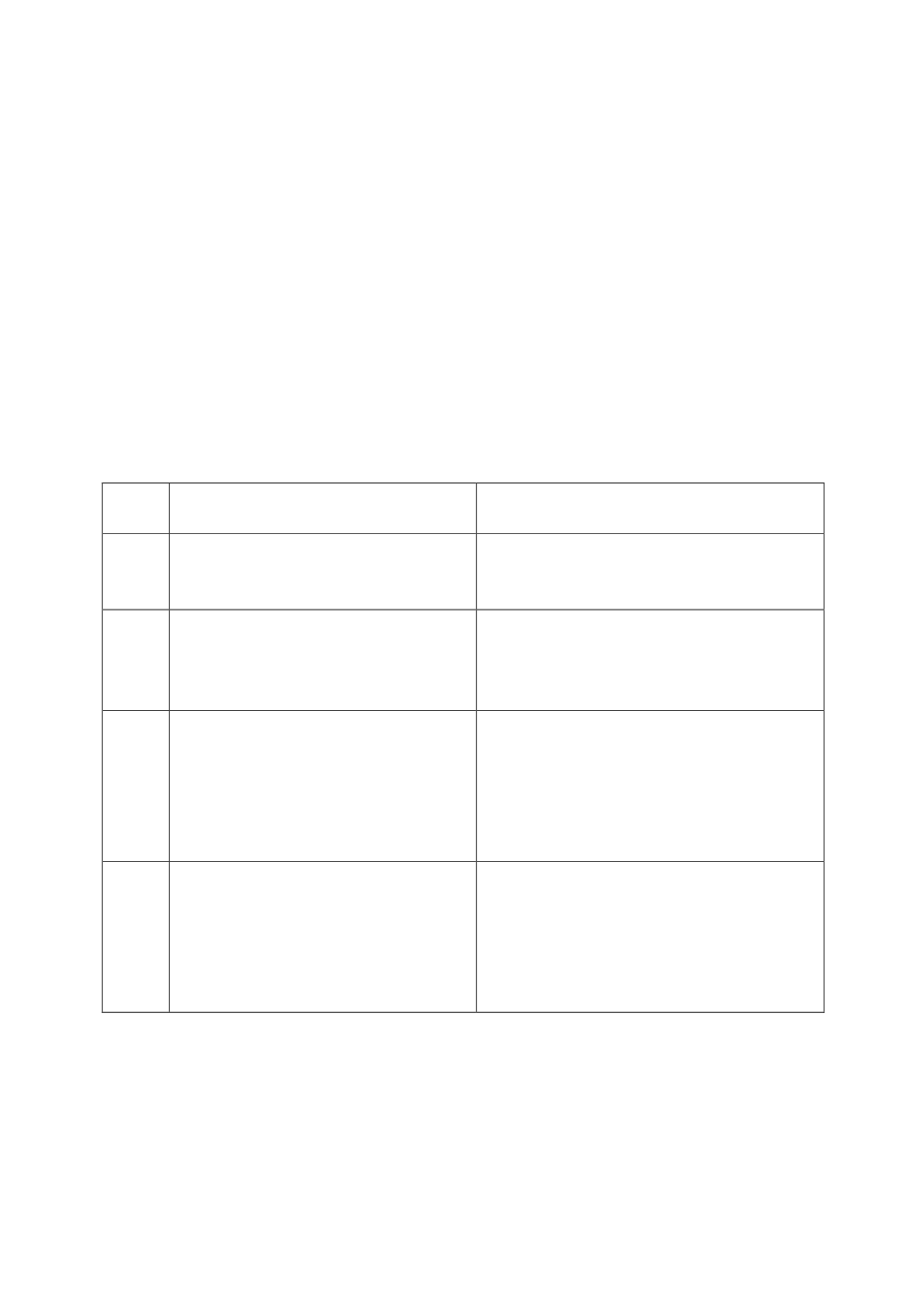
Таблица
8
Фазы
КИ
УчастникиКИ
ЦельКИ
1.
Здоровые добровольцы
(20-80
человек
)
Первый
опыт
применения
нового
ЛС
,
оценка
безопасности
ЛС
,
диа
-
пазонапереносимых доз
.
2.
Больные добровольцы
(50-300
человек
,
страдающих
заболеванием
,
которое
должно
лечитьиспытываемоеЛС
)
Определение
терапевтической
эф
-
фективности
ЛС
,
минимальной
и
поддерживающей
дозы
,
побочных
эффектов
.
3.
Больные добровольцы
(1000
иболее человек
)
Уточнение
эффективности
и
без
-
опасности
(
в
сравнении
с
другими
ЛС
),
взаимодействие
с
другими
ЛС
.
Стандартный
дизайн
–
двойное
слепое
тестирование
.
4.
Больные добровольцы
(
десятки
тысяч
).
Пострегистрационные
(
марке
-
тинговые
)
исследования
после
лицензирования
и
выхода
ЛС
на рынок
.
Уточнение
побочных
эффектов
придлительномприеме
.
Дизайн
КИ
может
быть
разным
,
КИ
подразделяются
на
не
-
сколько
видов
в
зависимости
от
условий
их
проведения
,
в
част
-
ности
,
степениинформированностиучастников
(
рис
. 8).


