Упрощенная HTML-версия
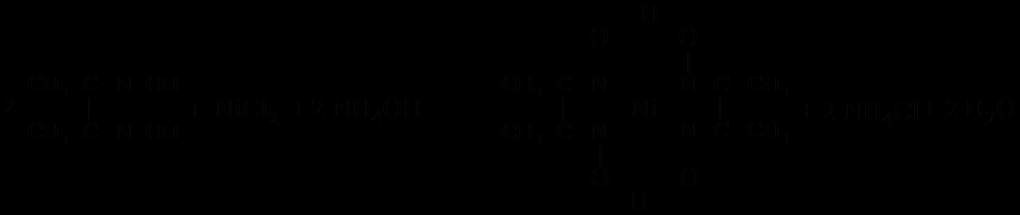
NiCl
2
+ 2 NaOH Ni (OH)
2
+ 2 NaCl
В разбавленных растворах осадок образуется при нагревании и стоянии.
Выполнение: к 2-3 каплям раствора соли кобальта прибавить 2 капли 2 н. раствора
уксусной кислоты, 2 капли раствора CH
3
COONa и немного твердого KNO
2
. Смесь
нагревают несколько минут на водяной бане. Наблюдают появление осадка.
4. С гидрофосфатом натрия Na
2
HPO
4
.
Гидрофосфат натрия образует с ионами кобальта фиолетовый осадок Co
3
(PO
4
)
2
,
растворимый в кислотах, в том числе и в уксусной. При действии щелочей этот осадок
превращается в Co(OH)
2
, при действии аммиака растворяется с образованием
комплексной соли грязно-желтого цвета.
Аналитические реакции ионов никеля.
1. С едкими щелочами и аммиаком.
а)
NaOH и KOH
образуют с Ni
2+
зеленый осадок основной соли Ni(OH)
2
.
Осадок растворим в кислотах, аммиаке и солях аммония.
б)
NН
4
OH дает с Ni
2+
сначала зеленый осадок основной соли (NiOH)
2
SO
4
, который
затем растворяется в избытке аммиака с образованием комплексного соединения синего
цвета.
Выполнение: в пробирки поместить по 3-4 капли раствора соли никеля, прибавить по 1-2
капли растворов щелочи или аммиака. Полученные осадки испытать на растворимость в
HCl, NaOH, NH
4
OH и солях аммония.
2. С гексацианоферратом (II) калия K
4
[Fe(CN)
6
].
Желтая кровяная соль осаждает из растворов солей никеля желто-зеленый осадок
Ni
2
[Fe(CN)
6
], который нерастворим в разбавленных кислотах, но растворим в избытке
аммиака и разлагается щелочью.
Выполнение: к 3-4 каплям раствора соли никеля добавить 3-4 капли раствора K
4
[Fe(CN)
6
].
Полученный осадок проверить на растворимость в кислотах, аммиаке и щелочах.
3. С диметилглиоксимом (реактивом Чугаева).
Реактив Чугаева является чувствительным реагентом на ионы никеля. В
аммиачной среде он образует с ними характерный красный осадок внутрикомплексной
соли.
С диметилглиоксимом комплексные соединения также образуют и другие ионы,
например, ионы меди (II) (оранжево-красного цвета), ионы железа (II) (красноватого
цвета), ионы кобальта (II) (коричнево-красного цвета). Однако они более растворимы в
воде, чем диметилглиоксимат никеля.
2 NiSO
4
+ 2 NH
4
OH (NiOH)
2
SO
4
+ (NH
4
)
2
SO
4
(NiOH)
2
SO
4
+ 14 NH
4
OH 2 [Ni (NH
3
)
6
](OH)
2
+ (NH
4
)
2
SO
4
+ 12 H
2
O

