Упрощенная HTML-версия
бумагу, пропитанную раствором крахмала и калия иодида, и затем высушенная.
Контроль за ходом титрования ведут, периодически отбирая каплю титруемого
раствора и нанося его на йодкрахмальную бумагу. После т.э. бумага становится
синей. Титрование прекращают тогда, когда капля титруемого раствора,
отобранная через минуту после прибавления титранта к определяемому раствору,
сразу же окрашивает бумагу в синий цвет. Параллельно проводят контрольный
опыт.
Применение метода нитритометрии
:
1.
для количественного определения первичных ароматических аминов,
нитропроизводных, которые могут быть восстановлены до ароматических аминов,
а также для определения ароматических и алифатических вторичных аминов,
гидразидов и т.д.;
2.
для определения неорганических веществ – олова (II), мышьяка (III), железа (II) и
т.д.;
3.
С помощью метода определяют лекарственные препараты: анестезин, дикаин,
левомицетин, новокаин, сульфадимезин, сульфацил-натрий, уротропин, этазол и
др.
4.6. Метод комплексонометрического титрования
В количественном анализе помимо рассмотренных в предыдущих главах реакций
широко применяются реакции комплексообразования, соответственно метод титрования
называется
комплексонометрическим
.
Метод коплексонометрии основан на образовании прочных, растворимых в воде
бесцветных комплексов катионов металлов с трилоном Б (ЭДТА) – динатриевой солью
этилендиаминтетрауксусной кислоты. Независимо от заряда катиона взаимодействие его с
титрантом происходит в стехиометрическом соотношении 1:1.
Ионы многих металлов реагируют с донорами электронной пары, образуя
координационные соединения, или комплексные ионы. Вещества, способные быть
донорами
(лиганды),
должны иметь по меньшей мере одну неподеленную пару
электронов для образования связи. Примерами обычных лигандов, поставщиками
неподеленных электронных пар, в большинстве случаев являются молекулы воды, ам-
миака и ионы галогенидов и др.
Титриметрические методы, основанные на реакциях комплексообразования (иногда
называемые комплексометрическими или
трилонометрическими
методами), получили
свое развитие с открытием особого класса координационных соединений, называемых
хелатами
. Хелат образуется в результате координирования ионом металла двух или более
донорных групп одного лиганда.
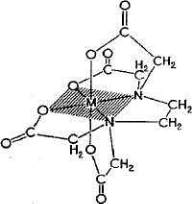
Рис. 4.6.
Структура комплекса металла с ЭДТА
Для титриметрического анализа
главным преимуществом
хелатообразующих
реагентов перед реагентами, образующими с ионом металла простые устойчивые
комплексы, состоит в том, что хелатообразование протекает практически в одну стадию,

