Упрощенная HTML-версия
становителями, чувствительными скорее к изменению потенциала системы, а не к
изменению концентрации одного из реагентов или продуктов реакции. Поэтому обычно
при построении кривой окислительно-восстановительного титрования по оси ординат
откладывают потенциал системы, а не отрицательный логарифм концентрации одного из
реагирующих веществ (так называемую p-функцию: pH, pMe, pOH и др.) от объема
добавленного реагента (титранта).
Для того, чтобы было ясно, что означает термин "электродный потенциал системы",
рассмотрим реакцию, протекающую при титровании железа (II) церием (IV):
Ce
4+
+ Fe
2+
↔ Ce
3+
+ Fe
3+
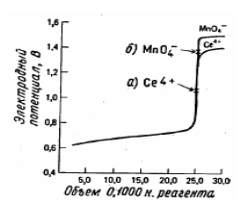
Рис.4.5. Кривые титрования 50.00 мл 0.0500 н. раствора Fe(II) 0.1000 н. раствором
Се(IV) (кривая 1) и 0.1000 н. раствором KMnO
4
(кривая 2).
а) точка эквивалентности при титровании раствором Се
4
+ ;
б) точка эквивалентности при титровании раствором KMnO
4
.
После каждого добавления титранта устанавливается равновесие, следовательно,
после добавления первой порции титранта количества всех четырех частиц,
присутствующих в растворе, будут определяться константой равновесия реакции. При
равновесии электродные потенциалы обеих полуреакций равны.
Если в растворе присутствует обратимый редоксиндикатор, то его потенциал также
должен быть равен потенциалу системы, которая рассчитывается как разность между
окисленной и восстановленной формами веществ.
В состоянии равновесия концентрационные соотношения окисленной и
восстановленной форм каждой частицы таковы, что сродство к электрону обоих
участников полуреакций (а потому и электродных потенциалов) идентично. Но в
процессе титрования соотношение концентраций обеих частиц непрерывно изменяется и
поэтому Е
сист
также должен изменяться. Изменение этого параметра служит
характеристикой системы и дает способ обнаружения конечной точки титрования.
При построении кривой титрования для расчета Е
сист
можно использовать и
Е(окислителя) и Е(восстановителя). В каждом отдельном случае выбирают то, что более
удобно. Вблизи точки эквивалентности концентрации железа (II) , железа (III) и церия
(III) легко вычислить, исходя из количества добавленного титранта. Концентрация церия
(IV) при этом будет пренебрежимо мала. Поэтому применение уравнения Нернста для
пары железо (III) - железо (II) позволяет найти непосредственно потенциал системы.
Составив соответствующее уравнение для пары церий (IV) -церий (III), мы получили бы
тот же самый ответ, но в этом случае сначала потребовалось бы рассчитать константу
равновесия реакции, чтобы найти величину концентрации церия (IV).

