Упрощенная HTML-версия
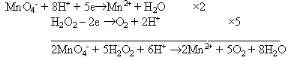
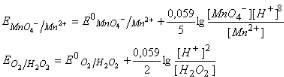
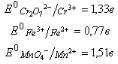
стандартный потенциал которой:
B35,0
6
45
,04 14,0
2
6
E4
E2
E
0
2
0
1
0
SH/ SOH
2 3 3
.
Пример3.
Составить уравнение реакции между перманганат-ионом и пероксидом водорода в кислой
среде электронно-ионным методом и записать уравнения Нернста для окислительно-
восстановительных систем.
Решение:
Составляем уравнения Нернста для окислительно-восстановительных систем:
Пример4.
Можно ли в кислой среде действием дихромата калия окислить: а) Fe
2+
до Fe
3+
; б) Mn
2+
до
MnO
4
-
?
Решение:
Для
решения
вопроса
необходимо
сравнить
стандартные
окислительно-
восстановительные потенциалы окислительно-восстановительных систем. Более сильным
окислителем будет окисленная форма той системы стандартный окислительно-
восстановительный потенциал, которой больше.
Потенциал системы Cr
2
O
7
2-
/Cr
3+,
больше, чем потенциал системы Fe
3+
/Fe
2+
и меньше, чем
потенциал системы MnO
4
-
/Mn
2+,
следовательно, Fe
2+
можно окислить до Fe
3+
действием
дихромата калия, а Mn
2+
до MnO
4
-
не окисляется.
4.5. Метод окислительно-восстановительного титрования.
4.5.3. Кривые титрования
В окислительно-восстановительном методе количественного анализа веществ
имеет большое значение подбор условий для титрования, способ фиксации точки
эквивалентности.
Исследование процесса титрования в редокс-метрии, как и в других методах
количественного определения осуществляют с помощью кривых титрования. При
титровании происходит изменение потенциала редокс-пар определяемого вещества и
титранта.
Кривая титрования выражает графическую зависимость между потенциалом
редокс-пар и объемом добавленного титранта.
При окислительно-восстановительном титровании в большинстве случаев
применяются индикаторы, которые сами по себе являются окислителями или вос-

