Упрощенная HTML-версия
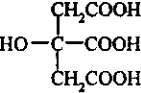
Методика.
В пробирку вносят 3—4 капли раствора тартрата, 3—4 капли
концентрированной H
2
SO
4
, прибавляют несколько кристалликов резорцина и осторожно
нагревают пробирку. Через 30 с раствор окрашивается в вишнево-красный цвет.
3. Реакция с аммиачным комплексом серебра.
При прибавлении к раствору тартрата
растворов нитрата серебра AgNO
3
и аммиака выделяется металлическое серебро. Вначале
раствор приобретает бурую окраску; при
кипячении
го него выпадает черный осадок
аморфного металлического серебра.
Методика.
В пробирку вносят 3—4 капли раствора тартрата, прибавляют 5—б
капель раствора AgNO
3
и столько же капель раствора аммиака. Раствор темнеет.
Осторожно нагревают смесь до кипения и кипятят около минуты. Выпадает черный
осадок металлического серебра.
4. Реакция с сульфатом железа(II) и пероксидом водорода.
Прибавление разбавленного
водного раствора сульфата железа (П) и пероксида водорода Н
2
О
2
к раствору,
содержащему тартраты, приводит к образованию неустойчивого комплекса железа
желтого цвета. Последующая обработка раствором щелочи NaOH приводит к
возникновению комплекса голубого цвета.
Методика.
К 5 мл водного раствора, содержащего около 15 мг растворенного
тартрата, прибавляют 0,05 мл 1%-го раствора FeS0
4
и 0,05 мл 10%-го раствора Н
2
О
2
.
Раствор окрашивается в желтый цвет. Через некоторое время желтая окраска исчезает.
После ее исчезновения к раствору прибавляют по каплям 2М раствор NaOH. Развивается
интенсивная голубая окраска раствора.
Аналитические реакции цитрат-нона
-
ООССН
2
-С(ОН)(СОО
-
)-СН
2
СОО
-
Цитрат-ион
-
ООССН
2
-С(ОН)(СОО
-
)-СН
2
СОО
-
- анион слабой (p
K
1
= 3,13, р
К
2
=
4,66,
р
К
3
=
6,4) трехосновной лимонной кислоты
Протон от спиртовой группы в растворах в обычных условиях практически не
отщепляется (р
К
4
= 16,0). Лимонная кислота хорошо растворима в воде. В водных
растворах цитрат-ионы бесцветны, подвергаются гидролизу, способны образовывать
устойчивые цитратные комплексы с катионами многих металлов.
Средний цитрат натрия растворяется в воде.
Средняя кальциевая соль лимонной кислоты малорастворима в горячей воде, но
хорошо растворяется в холодной воде, что используется на практике.
1. Реакция с хлоридом кальция (фармакопейная).
Цитрат-ионы при взаимодействии с
катионами кальция (хлорид или гидроксид кальция) в
нейтральной среде
не образуют
осадка — раствор остается прозрачным. При кипячении раствора из него выпадает белый
осадок среднего цитрата кальция:
2Cit
3-
+ 3Ca
2+
= Ca
3
Cit
2
где Cit
3+
— условное сокращенное обозначение среднего цитрат-иона.
Осадок растворяется при охлаждении смеси а также в разбавленной НСl.
Методика.
В пробирку вносят 5—6 капель нейтрального раствора цитрата и
прибавляют 5 - 6 капель раствора хлорида кальция СаС1
2
. Раствор остается прозрачным.
Осторожно нагревают смесь до кипения. Выделяется белый осадок. Охлаждают
пробирку с холодной водой. Осадок растворяется.
2. Реакция с уксусным ангидридом (фармакопейная).
Цитрат-ион при взаимодействии с
уксусным ангидридом (СН
3
СО)
2
О образует продукт реакции красного цвета.
Методика.
В пробирку вносят 3—4 капли раствора цитрата, прибавляют 3 - 4 капли
уксусного ангидрида и осторожно нагревают смесь. Примерно через минуту развивается
красная окраска раствора.

