Упрощенная HTML-версия
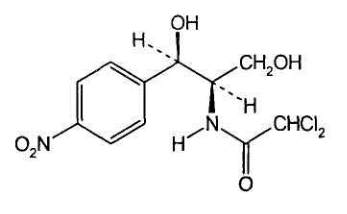
Молекула этого соединения включает два асимметрических атома углерода,
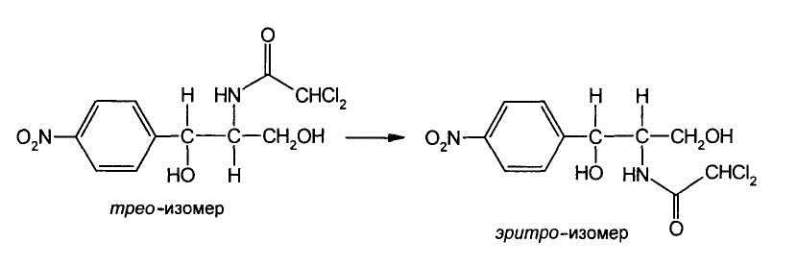
поэтому возможно существование четырех пространственных изомеров: D-mpeo, L-
mpeo, D-эритро, L-эритр. Трео- и эритро-изомеры отличаются пространственным
расположением функциональных групп в молекуле:
Хлорамфеникол является тpeo-изомером.
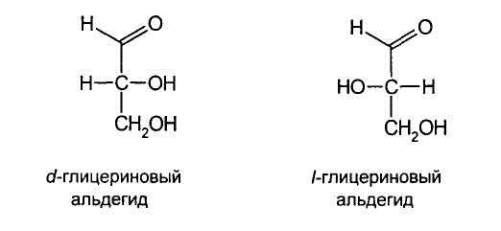
По характеру конфигурации асимметрического атома углерода в положении 1
оптически активные соединения относят к D- и L-ряду. D-ряд составляют
соединения, имеющие конфигурацию, подобную d-глицериновому альдегиду, а L-
ряд соответственно l глицериновому альдегиду:
Оптическая активность зависит от конфигурации всех асимметрических атомов
углерода, поэтому как в D-ряду, так и в L-ряду могут быть и левовращающие и
правовращающие изомеры. Знак вращения плоскости поляризованного света (+)
или (—) указывается в скобках после обозначения конфигурации.
Геометрические
и
оптические
изомеры
n-нитрофенил-2-
дихлорацетиламинопропандиола-1,3 отличаются по физиологической активности.
D-(-)- и L (+)-эриnро-формы представляют собой токсичные вещества и поэтому в
медицине не применяются. Природный хлорамфеникол соответствует О-(-)-трео-
изомеру, т.е. является левовращающим изомером тpeo-формы. Ввиду этого он
получил название левомицетин. L-(+)-mpeo-изомер (правовращающий антипод
хлорамфеникола) — физиологически неактивное вещество.
Смесь D-(-)- и L-(+)-трео-изомеров известна под названием
синтомицина.
Необходимо отметить, что удельное вращение раствора хлорамфеникола в
этилацетате равно -25,5°. Однако его растворы в этаноле вращают плоскость

