Упрощенная HTML-версия
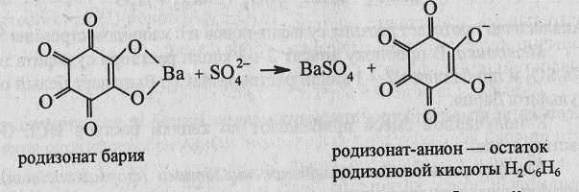
раствора ВаС1
2
. Выпадает белый осадок сульфата бария.
2. Реакция с катионами свинца.
Сульфат-ион дает с катионами свинца Рb
2+
белый кристаллический осадок
сульфата свинца PbSO
4
. Осадок частично растворяется в минеральных кислотах;
растворяется в щелочах и в водных растворах ацетатов натрия или аммония с
образованием комплексных соединений.
Методика. В пробирку вносят 3—4 капли раствора сульфата натрия, прибавляют 2—3
капли раствора нитрата свинца Pb(NO
3
)
2
. Выпадает белый осадок сульфата свинца.
3. Реакция с родизонатом бария.
Сульфат-ионы при взаимодействии с красным родизонатом бария разрушают его с
образованием сульфата бария, вследствие чего красный родизонат бария обесцвечивается.
Реакция высокочувствительна: предел обнаружения 5 мкг. Реакцию обычно проводят
капельным методом на фильтровальной бумаге.
Методика. На листок фильтровальной бумаги наносят каплю раствора хлорида бария
ВаС1
2
и 1 каплю раствора родизоната натрия Na
2
C
6
O
6
или родизоновой кислоты Н
2
С
6
О
6
.
На бумаге возникает красное пятно родизоната бария. На это пятно наносят 1—2 капли
раствора, содержащего сульфат-ионы (разбавленной серной кислоты или растворимых
сульфатов). Пятно обесцвечивается.
Аналитические реакции сульфит-иона SO
3
2-
.
Сульфит-ион SO
3
2-
и гидросульфит-ион HSO
3
-
— анионы двухосновной
нестабильной в водных растворах сернистой кислоты H
2
SO
3
. В водных растворах
сульфит-ионы бесцветны, подвергаются гидролизу, являются сильными восстановителями
(уже в водных растворах они медленно окисляются кислородом воздуха до сульфатов).
Сульфит-ион обладает довольно эффективными комплексообразующими свойствами как
лиганд. Средние сульфиты натрия и калия хорошо растворяются в воде, средние
сульфиты других металлов, как правило, малорастворимы в воде. При действии кислот на
сульфиты они разлагаются.
1. Реакция с хлоридом бария (фармакопейная).
Сульфит-ионы при взаимодействии с катионами бария образуют белый
кристаллический осадок сульфита бария BaSO
3
. Осадок растворяется в разбавленных НС1
и HNO
3
с выделением газообразного диоксида серы SO
2
.
Методика. В пробирку вносят 2—3 капли раствора сульфита натрия Na
2
SO
3
и прибавляют
2—3 капли раствора ВаС1
2
. Выпадает белый осадок сульфита бария. К полученной смеси
прибавляют по каплям раствор НС1. Осадок растворяется.
2. Реакция разложения сульфитов кислотами (фармакопейная).
Все сульфиты разлагаются минеральными кислотами с выделением газообразного
диоксида серы SO
2.
Выделяющийся диоксид серы обнаруживают по характерному запаху,
а также по обесцвечиванию водного раствора иода или перманганата калия. Разложение
сульфитов под действием кислот ускоряется при нагревании и при понижении рН среды.
Методика. В пробирку вносят 5—6 капель раствора сульфита натрия, прибавляют столько
же капель раствора НС1 или H
2
SO
4
и встряхивают пробирку с раствором. Постепенно
выделяется газообразный диоксид серы с характерным запахом.
3. Реакция с нитратом серебра.

