Упрощенная HTML-версия
Рассмотрим титрование сильной кислоты HCl сильным основанием КОН. В процессе
титрования протекает химическая реакция:
Н
+
+ Cl
-
+ K
+
+ OH
-
= H
2
O + Cl
-
+ K
+
.
Оба электролита полностью диссоциированы на ионы. В ходе титрования происходит
связывание ионов Н
+
, а вместо них появляются ионы K
+
, имеющие меньшую подвижность
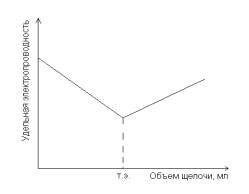
(см. Приложение). Таким образом, по мере добавления раствора щелочи
электропроводность раствора уменьшается вплоть до точки эквивалентности. После
достижения т.э., отвечающей полной нейтрализации кислоты, прибавление щелочи
(титрованного раствора) вызывает возрастание электропроводности раствора за счет
появления избытка ионов K
+
+ OH
-
. Кривая кондуктометрического титрования буде
выглядеть следующим образом:
Рис. 10. 1. Титрование сильной кислоты сильным основанием.
Из рис. 10.1 видно, что излом на кривой титрования соответствует точке
эквивалентности. Для расчета концентрации определяемого раствора пользуются законом
эквивалентов:
c
x
V
x
= c
т
V
т
,
(10.9)
где V
x
и V
т
– объемы определяемого раствора и титрованного раствора, c
т
– молярная
концентрация эквивалентов титрованного раствора.
Форма кривой титрования зависит от подвижности ионов в растворе и от степени
диссоциации кислоты и основания.
С помощью кондуктометрии можно проводить титрования следующих типов: слабая
кислота – сильное основание, слабая кислота – слабое основание, многоосновная кислота
– сильное основание, смесь кислот – сильное основание и т.д. Для кондуктометрического
титрования
можно
пользоваться
кислотно-основными
и
окислительно-
восстановительными реакциями, реакциями осаждения и комплексообразования. Однако
кривые титрования будут иметь вид, отличный от кривой на рис .10.1.
Метод кондуктометрического титрования пригоден для титрования разбавленных до
10
-4
М растворов кислот и оснований. В целом применение кондуктометрического
титрования имеет практическое значение в тех случаях, когда раствор настолько сильно
окрашен, что индикаторный электрод не может дать удовлетворительных результатов.
Например, кондуктометрия применяется для титрования слабых кислот (нитрофенолов,
фенолфталеина и др.), соли которых окрашены.
10. Кондуктометрический метод анализа
10.3. Практика кондуктометрического метода анализа
Определение удельной электропроводности воды

