Упрощенная HTML-версия
[OH
-
]
полн. осажд. Fe(OH)3
=
3
6
38
10
10
3,6
= 4,0 ∙ 10
-11
моль/л (рН = 3,60).
[OH
-
]
нач. осажд.
Cd(OH)2
=
3
14
1,0
2,2
10
= 4,7 ∙ 10
-7
моль/л (рН = 7,67).
[OH
-
]
полн. осажд. Cd(OH)2
=
3
6
14
10
10
2,2
= 1,5 ∙ 10
-4
моль/л (рН = 10,17).
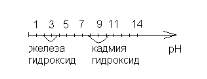
Построим графическую зависимость процессов осаждения катионов от рН:
ОТВЕТ.
Дробное осаждение в данной смеси возможно. Для этого нужно создать рН от 3,60 до
7,67 (грубо от 4 до 7), и тогда железа гидроксид будет полностью осажден, а осаждение
кадмия гидроксида еще не начнется.
2.2. Гетерогенные равновесия в системе осадок – насыщенный раствор.
2.2.5. Примеры решения задач.
Пример1.
Рассчитайте произведение растворимости хромата свинца PbCrO
4
, если 1,0 л его
насыщенного раствора содержит 4,4∙10
-5
г хромата свинца PbCrO
4
.
Дано:
ПР
-
?
Решение:
Зная массу PbCrO
4
в его насыщенном растворе, найдем молярную концентраци
PbCrO
4
его насыщенного раствора, т.е. растворимость:
мол
10 36,1
0,1 323
104,4
PbCrO
)
PbCrO (
PbCrO
PbCrO
PbCrO
PbCrO
7
5
4
4
4
4
4
4
ра р
V
M
m
ра р
V
n
S
Найдем связь растворимости с произведением растворимости и рассчитаем его:
PbCrO
4 тв.
↔ Pb
2+
+ CrO
4
2-
ПР(PbCrO
4
)=
a
(Pb
2+
)∙
a
(CrO
4
2-
), т.к.
a=С∙γ
, ПР(PbCrO
4
)=[Pb
2+
]∙[CrO
4
2-
]∙
2
4
2
CrO
Pb
,∙
поскольку раствор PbCrO
4
водный и его концентрация мала, пренебреже
электростатическим взаимодействием между ионами, т.е.
I
= 0,
γ
1.
ПР(PbCrO
4
)=[Pb
2+
]∙[CrO
4
2-
], т.к. [Pb
2+
]=[CrO
4
2-
]=
S
ПР(PbCrO
4
) =
S
2
=
(1,36∙10
-7
)
2
= 1,9∙10
-14
.
m
(PbCrO
4
)
=
4,4
∙10
-5
г
V
р-ра
(PbCrO
4
)
=
1,0 л
Ответ: ПР = 1,9∙10
-14
.
Пример 2.
Рассчитайте и сравните растворимость в воде хлорида и хромата серебра.

