Упрощенная HTML-версия
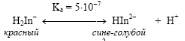
4.6.4. Индикаторы в комплексонометрическом титровании
При комплексонометрическом титровании конечную точку титрования обычно
фиксируют с помощью металлохромных индикаторов (
металлоиндикаторов),
образующих с определяемым веществом менее устойчивый комплекс, чем с титрантом.
Для титрования с помощью ЭДТА и других хелатообразующих реагентов
предложен ряд металлоиндикаторов.
Как правило, эти индикаторы представляют собой органические красители,
образующие с ионами металла хелаты в интервале рМ (показатель концентрации металла,
применяемый для построения кривой титрования), зависящем от свойств катиона и
индикатора. Часто комплексы настолько интенсивно окрашены, что окраска заметна даже в
интервале 10
-6
-10
-7
М.
Большинство металлоиндикаторов обладает способностью присоединять протоны и
образовывать соединения, окрашенные почти так же, как и комплексы металлов.
Поэтому они являются кислотно-основными индикаторами и пригодны в качестве
металлоиндикаторов только в той области рН, где конкурирующая реакция с участием
протонов отсутствует.
В настоящее время получено более 150 металлохромных индикаторов. Ниже
приведены свойства некоторых наиболее широко применяемых в анализе лекарственных
веществ индикаторов, по химической структуре представляющие собой азосоединения.
Кислотный хромовый черный специальный или
эриохромовый черный Т.
Его
применяют в виде 0,05-0,5% этанольных растворов, при рН 9-10, который поддерживают с
помощью аммиачного буферного раствора
В
кислых и умеренно щелочных средах в растворе индикатора доминирует
равновесие:
Каждая из частиц
−
существует в различных таутомерных формах. При очень
высоких значениях рН наблюдается дальнейшая диссоциация HIn
2−
с образованием
оранжевого In
3−
.
Комплексы металлов с эриохромовым черным Т в основном красного цвета.
Поэтому он пригоден в качестве металлоиндикатора при рН = 7 и выше, где преобладает
голубая форма индикатора HIn
2−
.
В конечной точке титрования реакцию можно представить следующим образом:
МIn
−
+ HY
3−
↔ HIn
2−
+ MY
2−
красный голубой
Индикатор для титрования раствором ЭДТА должен образовывать с ионом металла
комплекс с константой устойчивости, в 10 раз меньшей, чем константа устойчивости
комплекса металла с ЭДТА, иначе титрование закончится преждевременно. Наоборот,
если различие в величинах констант устойчивости слишком мало, как, например, в
случае иона кальция, конец титрования будет фиксироваться слишком поздно.
Пригодность того или иного индикатора для титрования раствором ЭДТА можно
определить по изменению рМ
вблизи точки эквивалентности, если константа
устойчивости комплекса иона металла с индикатором известна.
Недостатком
эриохромового черного Т является малая устойчивость его растворов
во времени. Установлено, что этого недостатка лишены растворы
кальмагита
-
индикатора практически аналогичного поведения. Некоторые другие индикаторы в
отличие от эриохромового черного Т можно применять в сильно кислой среде.
Ксиленоловый оранжевый (КО)
относится к трифенилметановым индикаторам и
является шестиосновной кислотой. Окраска индикатора (в свободном состоянии)
изменяется при изменении рН среды: при рН 2,0 – 6,4 – желтая, при рН больше 6,4 –

