Упрощенная HTML-версия
неподеленной паре электронов, и поэтому обладает потенциальной возможностью
образовывать шесть связей с ионом металла и может рассматриваться как
шестидентатный лиганд.
Для представления формулы ЭДТА и ее ионов часто используют сокращения H
4
Y,
H
3
Y
-
, H
2
Y
2−
, HY
3−
и Y
4−
.
Свободную кислоту H
4
Y и дигидрат ее двунатриевой соли Na
2
H
2
Y-2H
2
O можно
получить в чистом виде. Свободную кислоту можно использовать в качестве первичного
стандарта после высушивания в течение нескольких часов при 130-145°С и растворения в
минимальном количестве щелочи.
ЭДТА обладает замечательными свойствами как с точки зрения высокой
устойчивости комплексов с металлами, так и с точки зрения универсальности. В
какой-то мере все катионы реагируют с ЭДТА. Образующиеся комплексы, за
исключением комплексов щелочных металлов, достаточно устойчивы, и это может
быть положено в основу титриметрических методов. Высокая устойчивость
комплексов обусловлена наличием в молекуле ЭДТА нескольких донорных групп,
которые могут образовывать симметричную малонапряженную структуру.
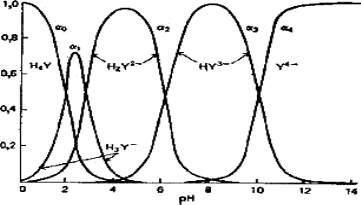
Состав растворов ЭДТА как функция рН
В водном растворе могут существовать пять форм ЭДТА. Относительное
количество каждой формы в данном растворе зависит от рН. Эти соотношения
удобно рассматривать с помощью графического изображения зависимости
величин α (доли общей концентрации ЭДТА, представляемой каждой отдельной
частицей) для различных форм как функции рН:
Рис.4.6.3. Состав раствора ЭДТА как функция рН.
α
0
= [H
4
Y]/C, α
1
= [H
3
Y
-
]/C и т.д.
С - сумма равновесных концентраций всех форм.
Таким образом, величины α представляют мольные доли каждой формы. На
рис 4.6.3. показано, каким образом α-величины различных форм ЭДТА связаны с
рН раствора.
Очевидно, что H
2
Y
2
− является доминирующей формой в умеренно кислой
среде (рН = 3-6). В интервале рН = 6-10 доминирует HY
3−
, и только при рН выше 10
начинает преобладать Y
4−
.
Эти соотношения сильно влияют на равновесия, существующие в растворах,
содержащих ЭДТА и различные катионы.

