Упрощенная HTML-версия
Комплексометрическое титрование является одним из старейших титриметрических
методов.
Например, о титровании иодид-иона раствором ртути (II) по реакции
H
g
2+
+ 4I −↔HgI
4
2
−
впервые сообщалось в 1834 г., метод определения цианид-иона, основанный на
образовании комплексного иона Ag(CN)
-
, описан Либихом в 1851 г.
В табл.4.6.3. приведены типичные титранты, не образующие хелатов, а также
некоторые примеры их применения.
Табл. 4.6.3. Типичные примеры титрования с помощью неорганических
комлексообразующих титрантов.
Титрант
Определяемое
вещество
Примечания
Hg(NO
3
)
2
Br
-
, Cl
-
, CNS
-
, CN
-
,
тиомочевина
Образуются незаряженные комплексы
ртути
(II);
используются различные индикаторы
AgNO
3
CN
−
Продукт реакции Ag(NO
3
)
2
-
; индикатор I
-
титруют до
появления мути AgI.
NiSO
4
CN
−
Продукт реакции Ni(CN)4
2
−; индикатор AgI; титруют до
появления мути AgI
KCN
Cu
2+
,Hg
2+
,Ni
2+
Продукты реакций Cu(CN)
4
2-
, Hg(CN)
4
2−
, Ni(CN)
4
2−
;
используются различные индикаторы
Независимо от типа реакции, используемой для титрования, ошибка титрования
уменьшается с увеличением полноты ее протекания. С этой точки зрения полидентатные
лиганды обладают также несомненным преимуществом перед монодентатными,
поскольку они образуют с ионами металлов более устойчивые комплексы.
Титрование органическими комплексообразующими реагентами
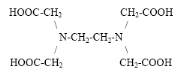
Этилендиаминотетрауксусная кислота (ЭДТА, Трилон Б)
является наиболее часто
используемой аминополикарбоновой кислотой.
Это слабая четырехосновная кислота:
pK
1
= 2.0; pK
2
= 2.67; pK
3
= 6.16; pK
4
= 10.26.
Значения констант показывают, что отщепление первых двух протонов протекает
значительно легче, чем отщепление двух оставшихся. Кроме четырех ионов водорода
карбоксильной группы молекула ЭДТА содержит два атома азота, имеющие каждый по

