Упрощенная HTML-версия
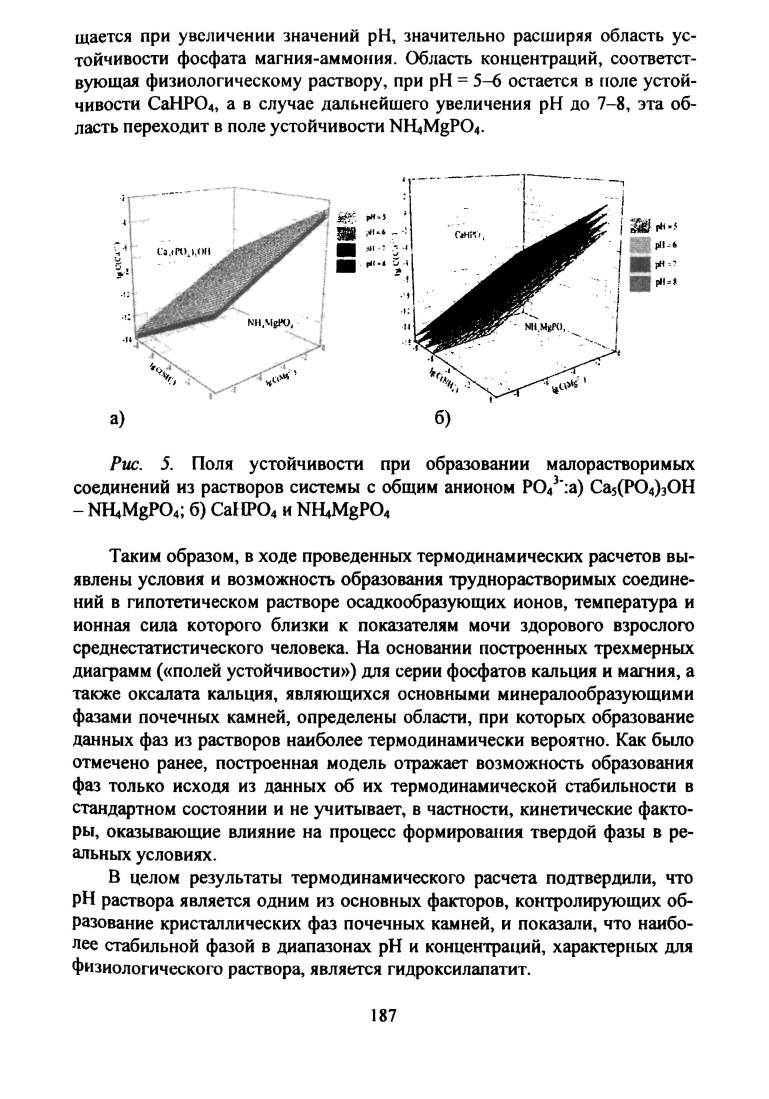
щается при увеличении значений pH, значительно расширяя область ус
тойчивости фосфата магния-аммония. Область концентраций, соответст
вующая физиологическому раствору, при pH = 5-6 остается в поле устой
чивости СаНР04, а в случае дальнейшего увеличения pH до 7-8, эта об
ласть переходит в поле устойчивости NRiMgP04.
Рис. 5.
Поля устойчивости при образовании малорастворимых
соединений из растворов системы с общим анионом Р043':а) Са5(Р04)30Н
- NH4MgP04; б) СаНР04и NR^MgPO,
Таким образом, в ходе проведенных термодинамических расчетов вы
явлены условия и возможность образования труднорастворимых соедине
ний в гипотетическом растворе осадкообразующих ионов, температура и
ионная сила которого близки к показателям мочи здорового взрослого
среднестатистического человека. На основании построенных трехмерных
диаграмм («полей устойчивости») для серии фосфатов кальция и магния, а
также оксалата кальция, являющихся основными минералообразующими
фазами почечных камней, определены области, при которых образование
данных фаз из растворов наиболее термодинамически вероятно. Как было
отмечено ранее, построенная модель отражает возможность образования
фаз только исходя из данных об их термодинамической стабильности в
стандартном состоянии и не учитывает, в частности, кинетические факто
ры, оказывающие влияние на процесс формирования твердой фазы в ре
альных условиях.
В целом результаты термодинамического расчета подтвердили, что
pH раствора является одним из основных факторов, контролирующих об
разование кристаллических фаз почечных камней, и показали, что наибо
лее стабильной фазой в диапазонах pH и концентраций, характерных для
физиологического раствора, является гидроксилапатит.
187

