Упрощенная HTML-версия
Са5(Р04)30Н», «Са5(Р04)30Н - NmMgP04», «Р-Са3(Р04)2 - СаС20 4»,
<<NH4MgP04
Р-Са3(Р04)2», «СаС20 4- СаНР04», как наиболее часто встречаемые в со
ставе почечных камней.
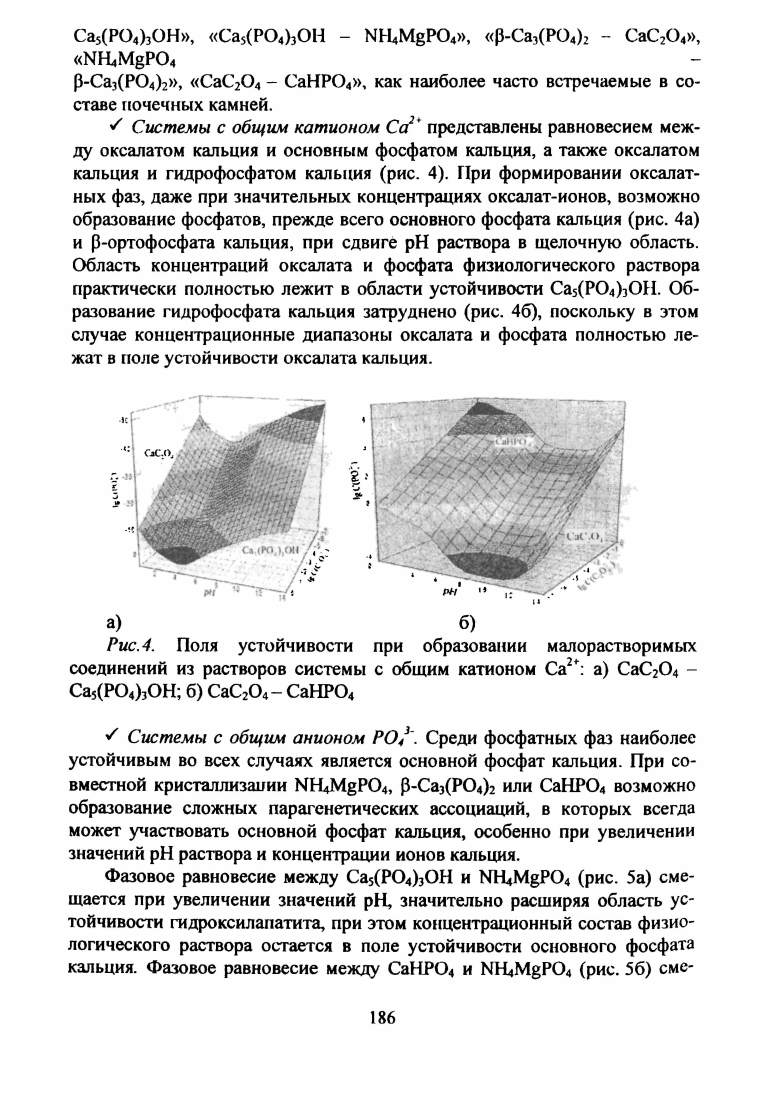
S Системы с общим катионом Са2+
представлены равновесием меж
ду оксапатом кальция и основным фосфатом кальция, а также оксалатом
кальция и гидрофосфатом кальция (рис. 4). При формировании оксалат-
ных фаз, даже при значительных концентрациях оксалат-ионов, возможно
образование фосфатов, прежде всего основного фосфата кальция (рис. 4а)
и p-ортофосфата кальция, при сдвиге pH раствора в щелочную область.
Область концентраций оксалата и фосфата физиологического раствора
практически полностью лежит в области устойчивости Са5(Р04)30Н. Об
разование гидрофосфата кальция затруднено (рис. 46), поскольку в этом
случае концентрационные диапазоны оксалата и фосфата полностью ле
жат в поле устойчивости оксалата кальция.
а)
б)
Рис. 4.
Поля устойчивости при образовании малорастворимых
соединений из растворов системы с общим катионом Са2+: а) СаС20 4 -
Са5(Р04)30Н; б) СаС20 4- СаНР04
S Системы с общим анионом РО / .
Среди фосфатных фаз наиболее
устойчивым во всех случаях является основной фосфат кальция. При со
вместной кристаллизаиии NH4MgP04, р-Са3(Р04)2 или СаНР04 возможно
образование сложных парагенетических ассоциаций, в которых всегда
может участвовать основной фосфат кальция, особенно при увеличении
значений pH раствора и концентрации ионов кальция.
Фазовое равновесие между Са5(Р04)30Н и NHjMgP04 (рис. 5а) сме
щается при увеличении значений pH, значительно расширяя область ус
тойчивости гидроксилапатита, при этом концентрационный состав физио
логического раствора остается в поле устойчивости основного фосфата
кальция. Фазовое равновесие между СаНР04 и NH*MgP04 (рис. 56) сме
186

