Упрощенная HTML-версия
биологической жидкости, равном 6,5 для каждой группы концентраций,
соответственно, Imin= 0,172 М; Imi(j “ 0,296 М и
-
0,425 М.
Из полученных данных следует, что при концентрациях ионов в рас
творе, моделирующем раствор мочи здорового взрослого среднестатисти
ческого человека, термодинамически вероятно образование следующих
соединений:
- C5H4N4O3
(мочевая кислота) в диапазоне pH 4,5-5,5;
- СаС20 4Н20 , СаС20 4-2Н20 , СаС20 4ЗН20 во всем исследуемом диа
пазоне pH 4,5-8,0;
- СаНР04-2Н20 (брушит) в диапазоне pH 6,0-8,0;
- Са5(Р04)30Н (апатит) в диапазоне pH 5,5-8,0;
- Са3(Р04)2(а) и Са3(Р04)2(р) (витлокит) в диапазоне pH 6,0-8,0;
- MgNH4P04*6H20 (струвит) в диапазоне pH 7,5-8,0.
Известно, что пересыщение в растворе может создаваться под влия
нием различных факторов, в частности, изменения температуры, pH, кон
центрации осадкообразующих ионов и т. д. Несмотря на то, что пересы
щение в растворе является движущей силой осаждения соли из раствора,
как правило, при данных условиях его критическая величина, при которой
начинается осаждение вещества, неодинакова для различных солей.
Исходя из полученных данных, в качестве исследуемых фаз были вы
браны минеральные компоненты мочевых камней и соединения, имеющие
высокие положительные значения индексов пересыщения в диапазоне pH
= 4,5 - 8,0 (рис. 1-2, табл. 4).
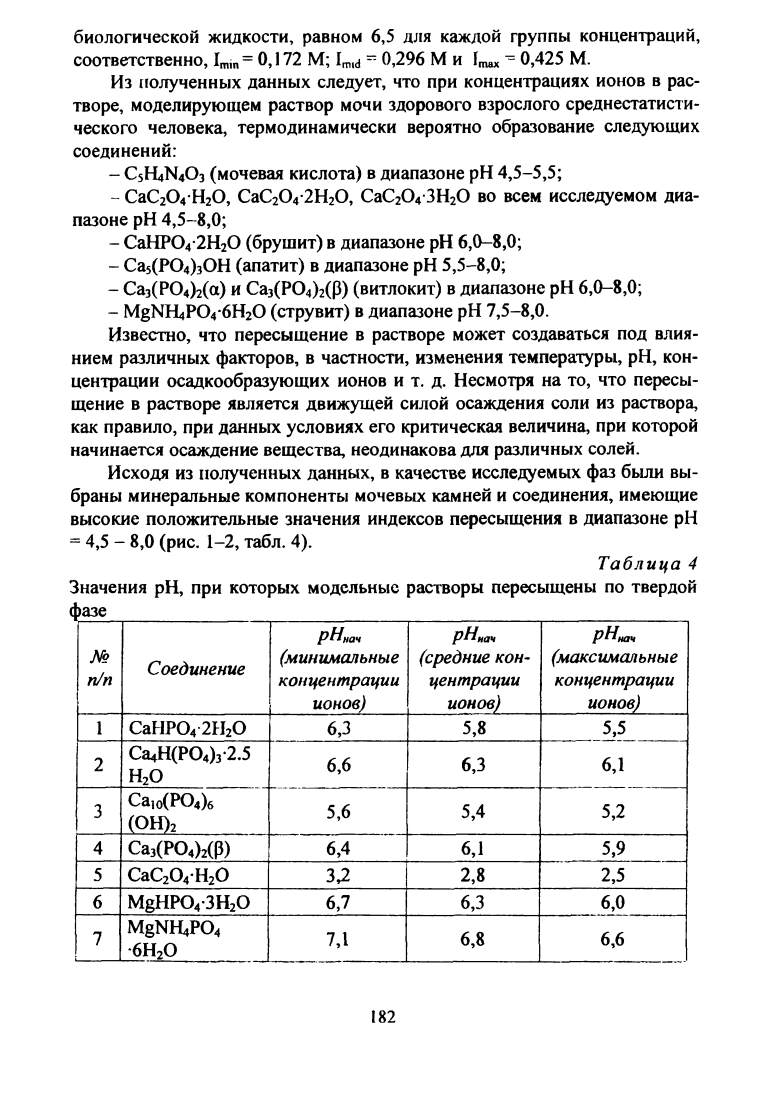
Таблица 4
Значения pH, при которых модельные растворы пересыщены по твердой
фазе
№
п/п Соединение
Р^нач
(минимальные
концентрации
ионов)
рНнач
(средние кон
центрации
ионов)
рНнач
(максимальные
концентрации
ионов)
1
СаНР042Н20
6,3
5,8
5,5
2 Са4Н(Р04)з-2.5
н2о
6,6
6,3
6,1
3 Са10(РО4)6
(ОН)2
5,6
5,4
5,2
4 Са3(Р04)2(Р)
6,4
6,1
5,9
5 СаС20 4Н20
3
Л
2,8
2,5
6 MgHP04-3H20
6,7
6,3
6,0
7 MgNHtP04
6Н20
7,1
6,8
6,6
182

