Упрощенная HTML-версия
2.
Электроды, на межфазных границах которых протекают ионообменные процессы
—
ионоселективные электроды (ИСЭ).
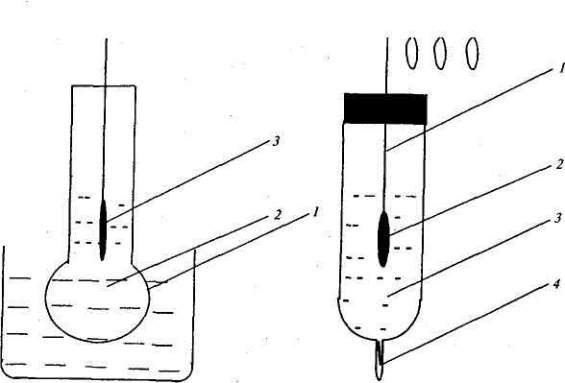
В потенциометрическом анализе чаще применяют мембранный стеклянный электрод
(рис.1), обратимый по ионам водорода. Потенциал такого стеклянного электрода
определяется концентрацией ионов водорода, поэтому ЭДС цепи, включающей
стеклянный электрод в качестве индикаторного, описывается при комнатной температуре
уравнением:
рН
КЕ
059 ,0
(7.3)
где постоянная
К
зависит от материала мембраны, природы электрода сравнения.
Стеклянный электрод позволяет определять рН в интервале рН = 0—10 (чаще в диапазоне
рН = 2—10) и обладает высокой обратимостью и стабильностью в работе.
В потенциометрии используют электроды следующих типов: электроды первого,
второго рода, окислительно-восстановительные, мембранные электроды.
Электроды первого рода
— это электроды, обратимые по катиону, общему с
материалом электрода. Различают три разновидности электродов первого рода:
Металл М, погруженный в раствор соли того же металла. Реальный потенциал
такого электрода первого рода зависит от активности катионов металла.
Газовые электроды, например, водородный электрод, в том числе и стандартный
водородный электрод. Потенциал обратимо работающего газового водородного электрода
определяется активностью ионов водорода, т.е. величиной рН раствора, и при комнатной
температуре равен: Е = -0,059рН, поскольку для водородного электрода стандартный
потенциал принимается равным нулю.
Амальгамные электроды, представляющие собой амальгаму металла, погруженную
в раствор, содержащий катионы того же металла. Потенциал таких электродов первого
рода зависит от активности катионов металла в растворе и активности металла в
амальгаме. Амальгамные электроды обладают высокой обратимостью.
Электроды второго рода
обратимы по аниону. Электроды второго рода обладают
высокой обратимостью и стабильны в работе, поэтому их часто используют в качестве
электродов сравнения, способных устойчиво поддерживать постоянное значение
потенциала.
Различают следующие виды электродов второго рода:
Металл, поверхность которого покрыта малорастворимой солью этого же металла,
погруженный в раствор, содержащий анионы, входящие в состав этой малорастворимой
соли. Примером могут служить хлорсеребряный электрод Ag/AgCl, КСl или каломельный
электрод Hg/Hg
2
Cl
2
, KC1.
Хлорсеребряный электрод состоит из серебряной проволоки, покрытой малорастворимой
в воде солью AgCl, погруженной в водный раствор хлорида калия. На хлорсеребряном
электроде протекает обратимая реакция: AgCl + е = Ag + Сl
-
(рис.7.2).

