Упрощенная HTML-версия
далее представлен термодинамический расчет равновесия для этой систе
мы.
Поля устойчивости
Результаты расчета термодинамического
равновесия
для
бинарной
системы
«гидроксилапатит-брушит»
представлены в виде трехмерных диаграмм, полученных по уравнениям
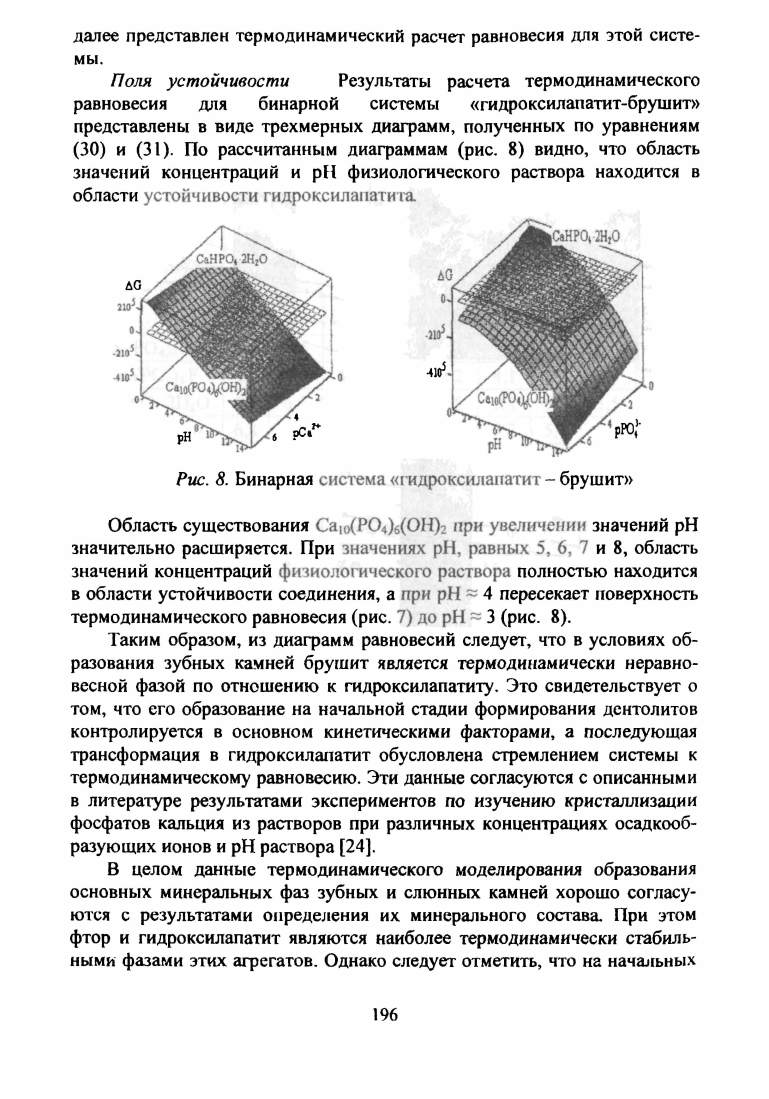
(30) и (31). По рассчитанным диаграммам (рис. 8) видно, что область
значений концентраций и pH физиологического раствора находится в
области устойчивости гидроксилапатита
Рис. 8.
Бинарная система «гидроксилапатит - брушит»
Область существования
Саю (Р04)б(0Н)2
при увеличении значений pH
значительно расширяется. При значениях pH, равных 5, 6, 7 и 8, область
значений концентраций физиологического раствора полностью находится
в области устойчивости соединения, а при pH ~ 4 пересекает поверхность
термодинамического равновесия (рис. 7) до pH ~ 3 (рис. 8).
Таким образом, из диаграмм равновесий следует, что в условиях об
разования зубных камней брушит является термодинамически неравно
весной фазой по отношению к гидроксилапатиту. Это свидетельствует о
том, что его образование на начальной стадии формирования дентолитов
контролируется в основном кинетическими факторами, а последующая
трансформация в гидроксилапатит обусловлена стремлением системы к
термодинамическому равновесию. Эти данные согласуются с описанными
в литературе результатами экспериментов по изучению кристаллизации
фосфатов кальция из растворов при различных концентрациях осадкооб
разующих ионов и pH раствора [24].
В целом данные термодинамического моделирования образования
основных минеральных фаз зубных и слюнных камней хорошо согласу
ются с результатами определения их минерального состава. При этом
фтор и гидроксилапатит являются наиболее термодинамически стабиль
ными фазами этих агрегатов. Однако следует отметить, что на начальных
196

